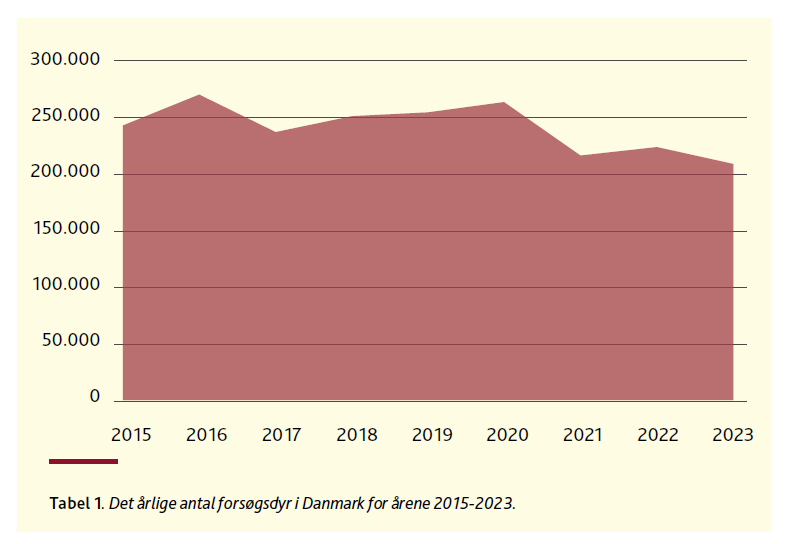
Der bliver i disse år talt meget om alternativerne, som skal erstatte forsøgsdyrene i forskningen. Vi anvender i Danmark hvert år i størrelsesordenen knap en kvart million forsøgsdyr, om end tallene har været lidt lavere for 2021-2023, som er de seneste tre år, vi har tal for (tabel 1). Der findes ingen opgørelse over, hvor meget alternativerne reelt bliver brugt, og faldet i forbruget af forsøgsdyr siden år 2020 kan derfor også skyldes andre forhold, end at forskerne har skiftet dem ud med alternativer. Konjunkturer, størrelsen af opnåede forskningsbevillinger og outsourcing af forskning til udlandet kan her spille afgørende ind.
De alternative metoder er vidt forskellige lige fra computermodeller til in vitro-forsøg, men i det følgende vil vi fokusere på tre af de mest lovende metoder, der baserer sig på celler, væv og sågar hele organer fra mennesker. Menneskebaserede alternativer er blevet populære, fordi man dermed undgår artsforskelle, som ellers kan gøre resultater fra dyreforsøg problematiske at overføre til mennesker – den såkaldte translatoriske krise, som mange i den prækliniske forskning har erkendt i de senere år.
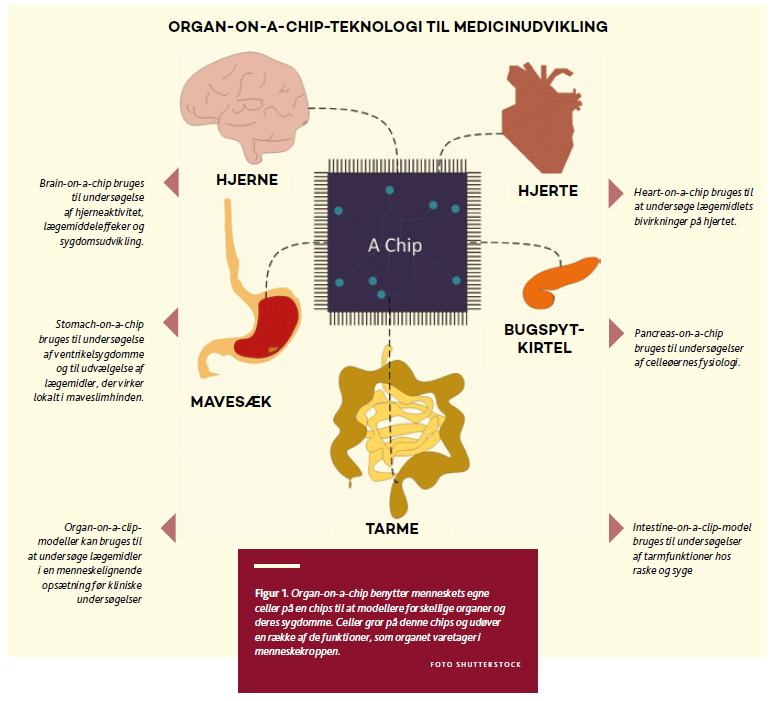
Et lovende og allerede anvendt alternativ til dyreforsøg er såkaldte organ-on-a-chip (figur 1), som er menneskeceller fastsat på mikrochips, hvor de simulerer miniatureorganer. Disse chips, der i størrelse typisk blot svarer til et USB-stick, er formet med et sindrigt system af huller og kanaler, som der kan ledes væsker, blod og luft igennem.
Menneskecellerne på disse chips vil kunne udføre en del af de samme funktioner, som cellerne bestrider i et rigtigt organ inde i et levende menneske. Eksempelvis vil cellerne i lunge-chips kunne udveksle ilt og kuldioxid mellem luft og blod – på lignende måde, som cellerne gør i lungealveolen hos os mennesker. Forsøg på organ-on-a-chip erstatter dermed dyreforsøg, men er også hurtigere og muligvis på sigt tillige billigere.
Organ-on-a-chip behøver ikke kun være raske organer, men kan også tilpasses, så de modellerer bestemte sygdomme – eksempelvis rygerlunger i form af kronisk obstruktiv lungesygdom (KOL). Ulempen er naturligvis, at organ-on-a-chip er et særdeles reduceret system, som langt fra afspejler en kompleks organisme i alle dets aspekter. Disse mangler bliver forsøgt reduceret ved at forbinde flere organ-on-a-chip med hinanden, ligesom organerne i kroppen er forbundet med hinanden via blodkar og nerver, men systemet er stadig meget reduceret i forhold til en kompleks organisme som et forsøgsdyr eller et menneske. Alene organstørrelsen er en udfordring, da organerne i et menneske er vidt forskellige i størrelse, men jo ret ens på en chip.
Organ-on-a-chip spås store muligheder indenfor afprøvning af nye lægemidler og til personlig medicin. Det bliver måske en dag muligt at beklæde chipsene med den enkelte patients egne celler. Det betyder, at medicin kan testes på chipsene, inden den enkelte patient udsættes herfor.
Organ-on-a-chip kan også give informationer om, hvordan bestemte etniske grupper eller patientgrupper med bestemte genetiske defekter vil reagere på medicinsk behandling. Det kan betyde, at nye lægemidler i højere grad skræddersyes til bestemte grupper af patienter, fremfor at de bliver godkendt til alle patienter med den pågældende lidelse.
Organoider er selvopbyggelige miniorganer
Organoider er beslægtede med organ-on-a-chip. Men i stedet for at bruge en chip, så dyrker man i stedet miniorganet i et 3D-sustrat i en petriskål. Organoiderne er små og ligner ikke nødvendigvis organer, men da cellerne er programmeret hertil, vil de have en række funktioner, svarende til eksempelvis hud, hjerne eller tarm (figur 2). På det mikroskopiske niveau organiserer cellerne sig på samme måde som i et organ.
Aarhus Universitet er involveret i et internationalt samarbejde om 3D-printede mininyrer bestående af pluripotente stamceller, der er programmeret til at udvikle sig til nyrens egne celler. Ved hjælp af omics-teknikker er mininyrerne blevet undersøgt, og deres molekylære protein-struktur minder forbløffende meget om, hvad man finder i nyrerne hos mennesker. Sådanne mininyrer skal bruges til at undersøge, hvordan inflammatoriske sygdomme påvirker proteinerne i nyrernes celler.
Som for organ-on-a-chip er også organoider stærkt reducerede systemer, der langt fra repræsenterer en hel organisme. Alligevel spås de gode muligheder for at besvare specifikke biomedicinske spørgsmål, såsom inflammation på celleniveau.

Figur 2. Tarm-organoid, der er baseret på vækst af Lgr5+-stamceller i et 3D-substrat. Foto Meritxell Huch (https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002149)
Væv og organer fra mennesker
Under kirurgiske indgreb bliver der undertiden væv til overs, som patienten kan vælge at testamentere til forskning. Modsat testamenteret væv fra afdøde, kan det kirurgiske væv benyttes straks, det er udtaget – hvormed cellerne stadig er levende.
På Syddansk Universitet har man fra operationer modtaget overskydende menneskehud, som bliver brugt til at teste, om kemiske stoffer kan trænge igennem huden. Typisk har man til sådanne undersøgelser tidligere anvendt grisehud, men der kan opnås mere pålidelige resultater, når huden stammer fra mennesker. På tilsvarende vis bruges væv og dele af indre organer, som bortopereres, til forskningsformål.
Hele organer fra mennesker er derimod af åbenlyse årsager sjældent tilgængeligt for forsøg, men placenta (moderkager) udgør her en vigtig undtagelse. På Rigshospitalet kan kvinder efter ukomplicerede graviditeter og fødsler vælge at testamentere deres moderkage til forskning.
Moderkagerne tilkobles i laboratoriet straks to separate blodcirkulationer, en for moderen og en for fostret, og opstillingen bruges til at undersøge, om kemiske stoffer kan passere placenta-barrieren – altså om børn potentielt er udsatte for de samme kemiske stoffer, som moderen indtager under graviditeten.
Foruden at spare forsøgsdyr har moderkagerne også den væsentlige fordel, at der anvendes væv fra mennesker. Placenta hos forsøgsdyr og mennesker er nemlig vidt forskellige i opbygning og passage, og derfor er det generelt vanskeligt at finde et egnet forsøgsdyr til sådanne forsøg. Omvendt har moderkagerne den væsentlige ulempe, at de naturligvis kun er indsamlet efter fødslen, og derfor ikke nødvendigvis repræsenterer tidlige graviditetsstadier, hvor fostrene også kan udsættes for kemiske stoffer. Så selv i dette tilfælde med moderkagerne kommer disse næppe til fuldt ud at kunne erstatte alle forsøg på levende dyr.
Kulturændring og udviklingsarbejde nødvendig
Der findes altså allerede i dag mange alternativer til dyreforsøg, men hvad begrænser så deres anvendelighed i praksis? Lad os se på et illustrativt eksempel. Ifølge WHO omgiver vi os med over 60.000 kemiske stoffer, men kun de færreste af disse er endnu blevet testet for skadelige virkninger, herunder deres eventuelle hormonforstyrrende egenskaber. Det vil kræve mange forsøgsdyr og lang tid, hvis alle stofferne skal testes på forsøgsdyr. Der er derfor hårdt brug for alternative metoder – både af dyreetiske, økonomiske og praktiske grunde.
DTU-Fødevareinstituttet har netop offentliggjort en videnskabelig artikel, hvor de viser, at selvom der faktisk findes alternative metoder til testning af hormonforstyrrende virkninger, og at EU principielt også tillader, at disse kan anvendes, når blot de er lige så effektive som dyreforsøg, så bliver alternativerne kun i begrænset omfang anvendt. Årsagen skal findes både hos forskerne og metoderne.
Read-across er en metode, hvor man anvender data fra testning af kendte kemiske stoffer til at vurdere risikoen for hormonforstyrrende egenskaber i beslægtede kemiske stoffer. Metoden kan allerede i dag anvendes, men bliver det kun i begrænset omfang – formentlig fordi al tilvænning tager tid. Andre metoder kræver derimod mere udviklingsarbejde, før de kan tages i anvendelse – altså før man er helt sikker på, at resultaterne er lige så pålidelige som ved dyreforsøg. Ingen ønsker jo at gamble med folkesundheden – at være den, der tager et alternativ i brug, som senere viser sig systematisk at overse en række sundhedsrisici med store konsekvenser til følge.
I 2004 tog EU et skridt mod udfasning af visse dyreforsøg, da de forbød testning af kosmetiske produkter på forsøgsdyr, og siden 2009 tillige at teste enkeltkomponenterne i kosmetik. Men en ting er kosmetiske stoffer – det vil være et stort spring at gøre det samme med andre kemiske stoffer og i særdeleshed med medicin. I 2021 vedtog EU-Parlamentet en resolution om, at Kommissionen aktivt skal arbejde for, at afviklingen af dyreforsøg sker hurtigt. Selvom alternativerne utvivlsomt vil vinde indpas indenfor mange forskningsområder, er det vanskeligt at forestille sig, at de helt kan erstatte alle dyreforsøg.





