Udbrud af alvorlige bakterieinfektioner i en svinebesætning kan både føre til betydelige økonomiske tab og kompromittere dyrevelfærden i besætningerne, og effektiv behandling er afgørende.
Dyrlæger kan anvende resistensundersøgelser for at mindske risikoen for behandlingssvigt. Det kan således få store økonomiske og dyrevelfærdsmæssige konsekvenser, hvis dyrlægerne ikke kan få testet sygdomsfremkaldende bakterier overfor relevante antibiotika. Desuden kan behandlingssvigt medføre gentagne behandlinger og på sigt øge resistensudvikling.
Hidtil har resistensundersøgelser på bakterier fra grise omfattet en række antibiotika, hvoraf en del i dag har begrænset relevans. Det drejer sig dels om ældre veterinære lægemidler dels en række antibiotika, som kun er relevante for humane patienter og overvågning af resistens, eksempelvis ciprofloxacin og erythromycin. Samtidig har andre nyere antibiotika, som er vigtige for behandling af grise i Danmark, ikke været inkluderet på panelerne. Efterhånden som nye antibiotikapræparater er udviklet, og resistensen er steget overfor ældre præparater, har der været en tiltagende efterspørgsel fra danske dyrlæger efter mere relevante resistensbestemmelser. Hovedårsagen til at panelerne ikke for længst er blevet opdateret er, at der har manglet etablerede tolkningsværdier for mange af de veterinære antibiotika.
Vi besluttede derfor at igangsætte et forskningsprojekt med det formål at designe nye resistenspaneler med tilføjelse af veterinært relevante antibiotika. Et hovedformål var at få fastlagt fortolkningsværdier for relevante kombinationer af antibiotika og bakterier, så resultaterne fra de nye paneler kan tolkes og dermed blive anvendelige i praksis.
Materialer og metoder
Tolkningsværdier for resistens: Kliniske breakpoint- og epidemiologiske cut-off-værdier (ECOFF)
Bakterier analyseres for antibiotikaresistens enten ved disc-diffusion eller fortyndingsmetoden, hvor der måles mindste inhiberende koncentration (MIC-værdier) for forskellige antibiotika. Ud fra MIC- værdien kan det vurderes, om bakterien er følsom eller resistent, ved at sammenligne med tolkningsværdien for den bestemte bakterie/antibiotika kombination.
Når resultaterne skal anvendes i klinisk sammenhæng, bør man ideelt set have såkaldt kliniske breakpoint-værdier til tolkning af MIC-værdierne. Hvorvidt et antibiotikum er klinisk effektivt, afhænger af bakteriens følsomhed og koncentrationen af antibiotikum i vævet over tid (lægemidlets PK/PD-egenskaber). Derfor fastsættes kliniske breakpoint-værdier for hver kombination af en patogen bakterie, antibiotikum ved en given dosering, dyreart og det relevante organ (hvor infektionen er).
Et klinisk breakpoint angiver, hvor følsom bakterien mindst skal være, for at der kan forventes klinisk effekt af behandling. Der er dog kun få kliniske breakpoint-værdier for grisepatogener, idet det blandt andet kræver et kostbart arbejde med dyreforsøg, og det kan derfor tage mange år, før relevante kliniske breakpoints bliver fastlagt. Et alternativ er at udvikle epidemiologiske cut-off (ECOFF)-værdier, som ikke kræver forsøgsdyr, men som bygger på datasæt af MIC-værdier.
Tabel 1. Bakterie-antibiotikakombinationer til MIC-bestemmelser i projektet.

De farvede felter angiver, at antibiotikummet er inkluderet på projektpanelet.
En epidemiologisk cut-off-værdi (ECOFF) skelner mellem de bakterier, som tilhører den følsomme vildtype-population, og de bakterier, som har nedsat følsomhed over for et givent antibiotikum som følge af erhvervede resistensgener. ECOFF angiver den øverste MIC-værdi i vildtype-populationen. Hvis et lægemiddel er godkendt til behandling af en bakterieinfektion, kan man med rimelig sikkerhed antage, at bakterien er klinisk følsom, hvis MIC-værdien er lig med eller under ECOFF-værdien.
ECOFF-værdier fastsættes af EUCAST/VetCAST for forskellige antibiotika og bakteriekombinationer på grundlag af MIC-data fra mindst 5 laboratorier ved anvendelse af den anbefalede metode. Data fra færre laboratorier kan dog anvendes til at fastsætte såkaldte tentative ECOFF-værdier (t-ECOFF), som kan anvendes vejledende, indtil ECOFFs eller relevante kliniske breakpoint-værdier fastsættes.
Materialer
Bakterier fra grise
I nærværende projekt blev fastlagt MIC-værdier for seks udvalgte vigtige sygdomsfremkaldende bakterier fra grise:
Escherichia coli (100 isolater) blev valgt som repræsentant for Enterobacteriaceae, fordi hæmolytiske E. coli (primært F4 og F18) er blandt de hyppigste årsager til diarré efter fravænning samt årsag til dødsfald pga. ødemsyge hos unggrise, og E. coli er den bakterie, der hyppigst indsendes til resistensundersøgelse.
Luftvejspatogenerne Actinobacillus pleuropneumoniae (99 isolater), Bordetella bronchiseptica (50 isolater) og Pasteurella multocida (50 isolater) blev valgt, fordi de er forbundet med alvorlige luftvejsinfektioner, hvilket er den hyppigste indikation for antibiotikabehandling næst efter mave-tarminfektioner.
Streptococcus suis (100 isolater) og Staphylococcus hyicus (50 isolater) blev valgt som repræsentanter for de gram-positive coccoide bakterier, idet de er også blandt de hyppigst forekommende behandlingskrævende bakterier hos grise.
Alle bakterieisolaterne var fra danske grisebesætninger, primært nyere isolater fra kliniske indsendelser til Laboratorium for Svinesygdomme (SEGES) og DTU Center for Diagnostik (CfD), suppleret med 33 P. multocida, 18 B. bronchiseptica og 36 S. hyicus-isolater fra CfD’s isolat-bank. Indsamling af isolater påbegyndtes i efteråret 2019, og blev afsluttet i perioden august-oktober 2020.
Relevante antibiotika
For hver af de valgte bakterier blev fastlagt, hvilke antibiotika der er relevante for behandling af grise i Danmark. De bakterie-antibiotikakombinationer, for hvilke der ikke allerede var etablerede tolkningsværdier, blev udvalgt til MIC-bestemmelse med henblik på fastlæggelse af tentative ECOFFs.
Tabel 1 viser de bakterie-antibiotikakombinationer, for hvilke der blev fastsat MIC-værdier og tECOFFs i projektet. MIC-bestemmelserne blev foretaget i henhold til CLSI-guidelines (CLSI 2017, CLSI 2018) på specialfremstillede MIC-paneler fra Thermo Fisher Scientific (Sensititre).
Fastlæggelse af tentative epidemiologiske cut-off-værdier
For hver kombination af bakterie og antibiotikum blev MIC-fordelingen anvendt til at estimere de relevante tentative epidemiologiske cut-off-værdier (t-ECOFF) ved hjælp af det statistiske soft-ware ECOFFfinder (Turnidge, 2006; ECOFFfinder). ECOFFfinder bruges til at finde den log-normal fordeling som bedst beskriver den observerede fordeling., ved en iterativ process. Figur 1 viser et eksempel på en MIC-fordeling og den modellerede fordeling i ECOFFfinder.
Figur 1. MIC-fordeling for doxycyklinaf 200 Actinobacillus pleuropneumonaeisolater1, og den iterativt tilpassede distribution (ECOFFfinder).
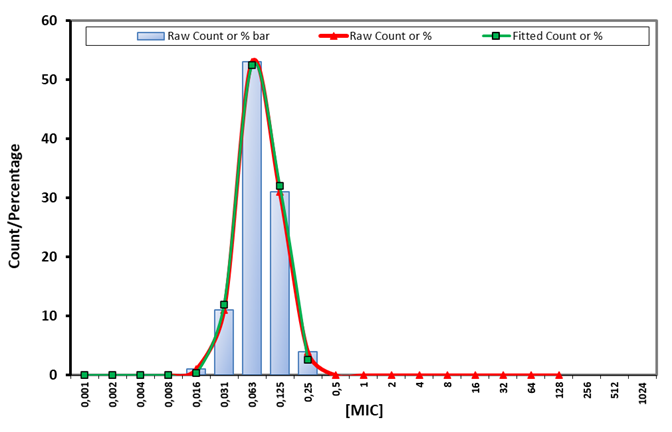
1. Data fra nærværende projekt samt EUCAST. Den øverste grænse for vildpopulationen (tECOFF) blev fastsat til MIC=2 (resistent>2).
Fastlæggelse af tolkningsværdier til nye resistenspaneler
Fastlæggelsen af tolkningsværdier afhænger af, hvilke data der er til rådighed. Generelt prioriteres kliniske breakpoints højt, fordi panelerne skal anvendes på kliniske isolater med henblik på behandling. Dog kan kliniske breakpoints være forbundet med usikkerhed, hvis de er baseret på lægemiddel-doseringer, som ikke anvendes i Danmark.
Tolkningsværdier til anvendelse på de nye paneler blev her fastlagt ud fra følgende kriterier i prioriteret rækkefølge:
- Hvis der er et klinisk CLSI-breakpoint for grise, anvendes dette – forudsat det er baseret på samme dosering, som anvendes i Danmark.
- Etablerede EUCAST ECOFF. MIC-værdier over ECOFF regnes for at indikere resistent i betydningen nedsat følsomhed (ikke nødvendigvis klinisk resistens).
- Subsidiært anvendes t-ECOFF beregnet på grundlag af data fra nærværende projekt sammenholdt med eventuelle data fra VetCAST, fra to publicerede studier (VetPath data: Garch et al, 2016; Thomas et al., 2016; De Jong et al. 2014) samt tidligere danske data (SEGES Laboratorium og DTU Veterinærinstituttet). Endvidere suppleres med andre publicerede data, hvis førnævnte er utilstrækkeligt (Kadlec et al., 2004; Prüller et al., 2016; Juhas et al, 2019).
- I nogle tilfælde kan ECOFF-finder ikke beregne t-ECOFF med de tilrådeværende data (den iterative beregning ikke mulig med den givne fordeling). I disse tilfælde anvendes visuel estimering (”Eyeball method”, Kahlmeter, 2013), dvs. ud fra den foreliggende MIC-fordeling vurderes visuelt, hvor ECOFF formentlig ligger. Denne metode er her kun anvendt for enkelte bakterie/antibiotikum-kombinationer.
Ad 3: Tolkningsværdier baseret på disse t-ECOFF blev i videst muligt omfang sammenholdt med eventuelle relevante data fra IMPART-studiet (endnu ikke publiceret, data stillet til rådighed af Kees Veldman). I de tilfælde, hvor IMPART studiet havde data på samme bakterie-antibiotikakombination, understøttede deres data vores t-ECOFF.
Kombinationspræparater udgør en særlig situation: I de få tilfælde, hvor der er etablerede ECOFF-værdier, anvendes disse. I øvrige tilfælde kan der potentielt være forskellige måder at fastsætte tolkningsværdien:
a) t-ECOFF, dvs. afvigelsen fra vildtypepopulation, som er følsom for begge antibiotika. Bakterier, som ikke er følsomme for begge antibiotika, tolkes som resistente.
b) Kun subpopulationen med resistens over for begge antibiotika tolkes som resistent.
Hvis der kun foreligger fordelingen for vildpopulationen, kan kun t-ECOFF bestemmes (ad a). Det kan være vanskeligt at afgrænse subpopulationerne (ad b), hvilket kan vanskeliggøres yderligere af, at der kan være synergi mellem de to stoffer (så viden om stofferne hver for sig kan ikke anvendes).
For nogle af bakterierne foreligger ECOFF for sulfomethoxazol- trimethoprim kombinationen (baseret på princip a). Vi besluttede så vidt muligt at anvende ECOFF hhv. t-ECOFFs, dvs. afgrænsning af vildtypepopulation for alle kombinationspræparaterne, til fastlæggelse af tolkningsværdier. Dette understøttes af, at man principielt ikke bør behandle med et antibiotikum (heller ikke i kombination), hvis der er kendt resistens over for dette, for at undgå unødig selektion af resistens.
Resultater
Valg af antibiotika til nye diagnostiske paneler
Der blev designet 3 nye paneler til hhv. Enterobactericeae (E. coli, Salmonella spp., Klebsiella spp.), luftvejsbakterier (Pasteurellaceae og Bordetella bronchiseptica) samt gram-positive coccoide bakterier (streptokokker og stafylokokker).
I rutinediagnostikken anvendes testpaneler med 96 brønde, således at der kan testes flere antibiotika i to-folds-fortyndinger. MIC-bestemmelserne anvendes således også til at fastlægge, hvilke fortyndinger der er nødvendige, for at resistenspanelet kan anvendes til de forskellige bakterier inden for gruppen.
Som udgangspunkt medtages alle antibiotika, som kan anvendes veterinært til at behandle infektioner hos grise (og kvæg), men ved pladsmangel på panelet må enkelte antibiotika udelades efter en prioritering ud fra væsentlighed i veterinær praksis.
Ved prioritering af antibiotika er indgået følgende overvejelser:
- Hvilke lægemidler kan mest oplagt anvendes i praksis
- Hvilke bakterier indgår i godkendelsen af lægemidlet (SPC)
- Forekomst af erhvervet og naturlig resistens - hvis stort set alle bakterierne er resistente, kan stoffet nedprioriteres
- Tilgængelighed af etablerede tolkningsværdier og/eller data.
Generelle betragtninger ved udvælgelse af antibiotika til de nye paneler:
Cefalosporiner blev nedprioriteret i forhold til andre relevante antibiotika, fordi 3.- og 4.-generations cefalosporiner til både kvæg og grise nu anvendes meget restriktivt. Ceftiofur blev inkluderet på luftvejspanelet, fordi det kun er godkendt til luftvejsinfektioner, mens cefquinom blev inkluderet på panelet til Enterobactericea, fordi det har en bredere indikation. Det er således stadig muligt at få undersøgt for resistens over for begge cefalospoiner, der kan anvendes til systemisk behandling af grise.
Amoxicillin anvendes meget, mens ampicillin ikke anvendes længere. Ampicillin repræsenterer amoxicillin ifølge de internationale guidelines fra CLSI, men for at sikre størst mulig anvendelighed i praksis blev det besluttet at bruge amoxicillin på de nye paneler.
Sulfonamid og trimethoprim indgår hver for sig på nogle af de gamle resistenspaneler, men i dansk veterinær praksis er sulfonamider og trimethoprim kun tilgængeligt som kombinationspræparater. Ydermere kan bakterierne i nogle tilfælde være følsomme over for kombinationen, selv om de har nedsat følsomhed over for stofferne individuelt. Sulfonamid og trimethoprim blev derfor inkluderet i kombination på de relevante resistenspaneler, hvormed der også blev mere plads til opprioritering af andre antibiotika.
Enrofloxacin er det eneste fluorokinolon, som er godkendt til grise og er inkluderet på de nye paneler, mens det humane fluorokinolon ciprofloxacin udgår.
De nyere langtidsvirkende makrolider (tulathromycin, tildipirosin og gamithromycin) samt tilmicosin og tylosin er inkluderet i stedet for det humane erythromycin. I udgangspunktet søges alle veterinære makrolider medtaget for at sidestille disse, medmindre der er andre begrundelser for at udelade enkelte makrolider.
Lincomycin og spectinomycin er inkluderet i kombination, fordi i) spectinomycin kun er tilgængeligt i denne kombination, ii) for orale præparater findes lincomycin kun i kombinationen, og iii) nogle studier indikerer, at der kan være synergi mellem de to antibiotika. Lincomicin findes som injektionspræparat og har primært effekt overfor gram-positive bakterier. Lincomycin er derfor også indkluderet på panelet til de gram-positive coccoide bakterier.
Tetracyklin har hidtil været anvendt som repræsentant for tetracyklinerne. Resultater fra nærværende studie indikerer, at tetracyklin og oxytetracyklin ikke altid er repræsentative for doxycyklin. Doxycyklin er derfor inkluderet på de nye paneler. Endvidere er oxytetracyklin så vidt muligt inkluderet i stedet for tetracyklin, fordi det - i modsætning til tetracyklin - anvendes veterinært Danmark.
Nyt resistenspanel til gram-negative luftvejsbakterier
De fastlagte tolkningsværdier for de udvalgte antibiotika for det nye panel til gram-negative luftvejsbakterier er vist i tabel 2.
Tabel 2. Tolkningsværdier1,2 for antibiotika på nyt resistenspanel for gram-negative luftvejsbakterier
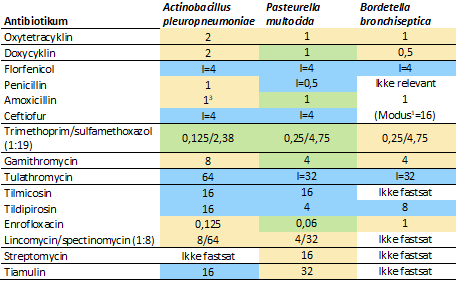
1. Værdierne angiver højeste MIC for følsomme isolater, hvis intet andet er angivet. I = MIC for isolater med intermediær følsomhed. Modus betegner den MIC-værdi, som er hyppigst forkommende.
2. Tolkningsværdierne er baseret på: Blå: Klinisk breakpoint, Grøn: ECOFF, Gul: tECOFF.
3. EUCAST tECOFF.
Amoxicillin med klavulansyre (amoxiklav) er ikke prioriteret på panelet, fordi der generelt er meget lav forekomst af resistens overfor ampicillin/amoxicillin i A. pleuropneumoniae og P. multocida, hvorfor det sjældent vil være relevant at anvende det mere bredspektrede amoxiklav.
Gamithromycin medtages, fordi det kan bruges til grise iht. kaskadereglen, og fordi panelet også forventes at blive brugt til kvægpatogener.
Tiamulin er godkendt til gram-negative luftvejsbakterier. Det bør dog bemærkes, at B. bronchiseptica synes at have lav følsomhed overfor tiamulin, idet >99% af isolaterne fra IMPART og VetPath-studierne har MIC-værdier over 32. Til sammenligning har S. hyicus ECOFF=2, M. haemolytica har ECOFF=32, og P. multocida har ECOFF=64, med modus=16 (modus= hyppigste værdi).
Der er kun plads til ét cefalosporin på panelet, men cefquinom og ceftiofur er begge godkendte til luftvejsinfektioner og kunne være relevante ved sjældne tilfælde af multiresistens. Det blev besluttet at prioritere ceftiofur på dette panel, mens cefquinom er med på panel til Enterobacteriaceae, hvorfor det vil være muligt i ekstreme tilfælde af multiresistens, at få testet luftvejsbakteriernes følsomhed overfor cefquinom. Det bør bemærkes, at B. bronchiseptica muligvis er naturligt resistent overfor cefquinom, da alle isolater havde MIC-værdier større end 4. Kendte ECOFF for cefquinom er mindre end 0,5 for andre bakterier (Mannheimia haemolytica og P. multocida), ligesom fordelingerne fra nærværende projekt indikerer, at ECOFF for A. pleuropneumoniae, E.coli og S. suis er mindre end 0,5.
Kombinationen lincomycin/spectinomycin erstatter spectinomycin på det nye panel. Der kunne ikke fastsættes en tolkningsværdi for B. bronchiseptica, idet alle isolaterne havde MIC≥32/256, dvs. over den valgte fortyndingsrække. Der forelå heller ikke andre anvendelige data for denne kombination. Kendte ECOFF for spectinomycin er for andre bakterier på <256. Det tyder på, at spectinomycin/lincomycin i kombination ikke kan anbefales til behandling af infektioner med B. bronchiseptica.
I Danmark er sulfamethoxazol og trimethoprim veterinært kun tilgængelige i kombination og er på det nye panel erstattet med kombinationen
I forhold til det gamle panel er de humane antibiotika udeladt: Tetracyklin, erythromycin og ciprofloxacin, som er erstattet af beslægtede veterinære antibiotika. Projektgruppen vedtog endvidere at udelade (nedprioritere) gentamicin og tylosin, idet disse antibiotika må betragtes som irrelevante til behandling af luftvejsinfektioner: Gentamicin er kun tilgængelig til gastrointestinal behandling af pattegrise. Tylosin er ikke medtaget, dels fordi det er tvivlsomt, om dyrlægerne vil bruge det til luftvejsinfektioner, dels indikerer vores resultater, at følsomheden er meget lav.
Streptomycin er medtaget på panel til luftvejsbakterierne og er tilgængeligt i kombination med penicillin. Imidlertid indikerer publicerede data, at de tre porcine luftvejsbakterier generelt har lav følsomhed over for streptomycin (Swedres 2017, Prüller 2015, Kadlec, 2004). Streptomycin er imidlertid medtaget på panelet, fordi det skal kunne anvendes til bakterier fra kvæg. Endvidere vil der over tid blive genereret data for porcine isolater, når panelet anvendes.
Nyt panel til gram-positive bakterier
Der er fastsat tolkningsværdier for S. hyicus og S. suis for alle antibiotika på panelet med en enkelt undtagelse (Tabel 3). Panelet kan imidlertid også anvendes til andre coccoide bakterier i det omfang, der er tilgængelige tolkningsværdier, eksempelvis er der for Staphylococcus aureus tolkningsværdier for de fleste antibiotika på panelet.
Tabel 3. Tolkningsværdier1 for antibiotika på nyt resistenspanel til gram-positive coccoide bakterier.
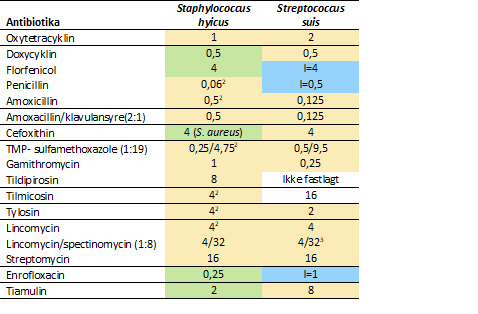
1. Værdierne angiver højeste MIC for følsomme isolater, hvis intet andet er angivet. I = MIC for isolater med intermediær følsomhed. Tolkningsværdierne er baseret på: Blå: Klinisk breakpoint, Grøn: ECOFF, Gul: tECOFF.
2. EUCAST tECOFF.
3. Understøttet af tECOFF for lincomycin.
Makrolider har generelt god effekt over for gram-positive bakterier og medtages alle for at sidestille disse – forudsat det tillades fra producentens side. Derfor er tulathromycin ikke medtaget, idet det ikke er godkendt til behandling af gram-positive bakterier.
Streptomycin bibeholdes, fordi det indgår i kombinationspræparat med penicillin. Da det er nødvendigt at have pencillin for sig selv, er kombinationen ikke inkluderet på panelet. Det skal bemærkes, at for S. suis er MIC-værdierne for tildipirosin meget høje – det bør overvejes, om der er naturlig resistens.
Behovet for brug af 3.- og 4.-generations cefalosporinerne er begrænset, idet der er lav forekomst af resistens over for en række andre antibiotika, som er til rådighed til behandling af disse infektioner hos grise. Cefoxitin bibeholdes som indikator for MRSA og andre methicillinresistente stafylokokker.
Amoxicillin er relevant, fordi det kan administreres peroralt i modsætning til smalspektret penicillin, der kun administreres parenteralt til grise. Penicillin burde være repræsentativt for amoxicillin, men det kan ikke garanteres. Desuden er det af mere pædagogiske årsager relevant at have amoxicillin med når amoxicillin-clavulansyre er med på panelet, så der ikke vælges peroral behandling med amoxicillin-clavulansyre, hvor amoxicillin er effektivt.
Til behandling af gram-positive bakterier er både lincomycin som injektionspræparat samt i kombination med spectinomycin (til peroral og injektionsbehandling) relevant og blev inkluderet på panelet.
Sulfamethoxazol og trimethoprim er kun tilgængelige i kombination og er på det nye panel erstattet med kombinationen.
I forhold til det gamle panel er udeladt de primært humant relevante antibiotika: Tetracyklin, kloramphenicol, erythromycin og ciprofloxacin, som er erstattet af beslægtede veterinære antibiotika.
Nyt panel til Enterobactericeae (E. coli, Klebsiella spp. mfl.)
For E. coli er fastsat tolkningsværdier for alle antibiotika på panelet (Tabel 4). Panelet kan også anvendes til Klebsiella spp. og Salmonella spp. i det omfang, der er tilgængelige tolkningsværdier (etablerede tolkningsværdier er vist i tabel 4).
Tabel 4. Tolkningsværdier1 for antibiotika på nyt resistenspanel til Enterobactericeae .
.
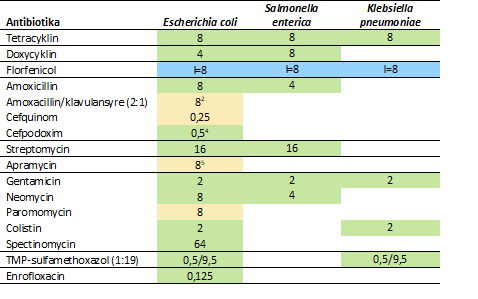
1. Værdierne angiver højeste MIC for følsomme isolater, hvis intet andet er angivet. I= MIC for isolater med intermediær følsomhed. Tolkningsværdierne er baseret på: Blå: Klinisk breakpoint, Grøn: ECOFF, Gul: tECOFF.
2. EUCAST tECOFF.
3. IMPART data understøttet af CLSI breakpoint for ampicillin.
4. Cut-off for ESBL suspekt.
5. tECOFF på grundlag af publicerede data (Juhas et al., 2019), understøttet af danske kliniske porcine isolater (SEGES).
Tetracyklin er med som repræsentant for oxytetracyklin, idet der ikke er tolkningsværdier fastsat for oxytetracyklin.
Spectinomycin er kun tilgængeligt i kombination med lincomycin, men for enterobactericeae er der ikke tolkningsværdier for kombinationen. Lincomycin er primært virksomt mod gram-positive bakterier, mens spectinomycin er virksomt mod gram-negative bakterier. Spectinomycin er derfor bibeholdt på dette panel.
Sulfamethoxazol og trimethoprim er kun tilgængelige i kombination og er på det nye panel erstattet med kombinationen.
Paromomycin er et nyere aminoglykosid, som kan anvendes til behandling af mavetarminfektioner hos grise. Det er effektivt over for en række bakterier, især gram-negative, herunder E. coli. Hidtil findes ingen viden om forekomsten af paromomycinresistens i danske grisebesætninger, men i nærværende projekt fandt vi nogle isolater, der var uden for vildtypefordelingen og med krydsresistens til neomycin.
I forhold til det gamle panel er de humane antibiotika udeladt: Chloramphenicol, cefotaxim, og ciprofloxacin, som er erstattet af beslægtede veterinære antibiotika. Nalidixan er ligeledes ikke tilgængeligt til behandling af kvæg og grise og er udeladt.
Diskussion
De nye paneler til resistensundersøgelse af bakterielle patogener fra grise vil blive anvendt til resistensundersøgelse på Veterinært Laboratorium, Kjellerup. Panelet til enterobactericeae er taget i brug medio marts, de øvrige paneler forventes taget i brug medio 2022.
De fastlagte tolkningsværdier vil blive anvendt i forbindelse med de diagnostiske undersøgelser, men tolkningsværdierne er dynamiske, idet de vil blive reguleret løbende iht. til kommende etablerede tolkningsværdier fra VetCAST eller CLSI.
Idet antibiotika reserveret til humant brug er udeladt fra de nye paneler, vil resultaterne være mindre egnede til den integrerede jord-til-bord-overvågning af antibiotikaresistens. Imidlertid er der fortsat overvågning af resistens i indikatorbakterier, som stammer fra produktionsdyrene, med anvendelse af mere human-relevante paneler (DANMAP).
Anvenelsen af de nye paneler vil på sigt give ny viden om forekomst af resistens over for de veterinære lægemidler og dermed danne et bedre grundlag for veterinære guidelines for antibiotikaforbrug.
Med de nye paneler vil der være forbedrede muligheder for optimal behandling af infektioner hos grise, hvilket forventes at medføre færre behandlingssvigt. Det kan forhåbentlig være medvirkende til at mindske resistensudvikling og have positiv effekt på produktivitet og dyrevelfærd.