Identifikationen og behandlingen af hunde og katte med kroniske smerter kan være udfordrende. Årsagerne til de kroniske smerter er mangeartede, og det kliniske udtryk varierer mellem patienterne. I nogle tilfælde viser vores patienter tydelige tegn på smerter: De halter, vokaliserer ved palpation eller undviger berøring af et bestemt område på kroppen. Hos andre kommer smerterne primært til udtryk i form af ændret adfærd.
De til tider diskrete adfærdsændringer kan udvikles over lang tid. Derfor er dyrenes ejer og dyrlæge ikke altid opmærksomme på, at adfærdsændringerne kan skyldes smerter, og undersøgelser peger på en mulig underdiagnosticering og -behandling af kroniske smerter på denne baggrund (1, 2).
Vi har begrænset viden om den overordnede forekomst af kroniske smerter blandt hunde og katte. I et tværsnitsstudie fra 2004 rapporterede Muir og kolleger forekomsten af smerter blandt alle ambulante patienter, der blev tilset i løbet af ét år på Ohio State Universitys undervisningshospital (3). Smerter blev konstateret hos 231/1.153 (20 %) af de undersøgte hunde og hos 92/952 (14 %) af de undersøgte katte. Blandt patienterne med smerte havde 17 % af hundene og 14 % af kattene kroniske smerter af mindst én måneds varighed. Forekomsten af kroniske smerter må med rimelighed antages at være på samme niveau i den danske hunde- og kattepopulation.
Kroniske smerter kan i princippet udvikles i alle kroppens strukturer. Overordnet kategoriseres kroniske smerter som nociceptive eller neuropatiske. Blandt de hyppigste årsager til kroniske nociceptive smerter hos hunde og katte er degenerative ledforandringer (DL) og osteoarthrose (OA). Røntgenforandringer forenelige med DL og OA anslås at forekomme hos 20-40 % af hundepopulationen og 74-90 % af kattepopulationen. Forekomsten øges i takt med dyrenes alder og mindst 40 % har kliniske tegn på smerter (4-7).
Neuropatiske smerter skyldes en læsion eller sygdom i nervesystemet som fx nervebeskadigelse efter traume eller operation, neoplasi eller syringomyeli. Nogle patienter har en blanding af nociceptive og neuropatiske smerter, som fx hunde med diskusprolaps, hvor 15 % af hunde rapporteres at have kroniske smerter efter hemilaminektomi (8, 9).
Behandlingen af kroniske smerter er svær, både på grund af det beskedne udvalg af veterinært indregistrerede præparater til PO-behandling af kroniske smerter, en generel mangel på tilstrækkeligt effektive smertestillende præparater og objektive parametre til at evaluere effekten af en behandling. De humant indregistrerede præparater kan endvidere være vanskelige at dosere korrekt særligt til de små patienter. Nogle præparater kræver enkeltdyrsudleveringstilladelse og nogle patienter – særligt katte – modsætter sig PO-behandling.
Ud over de rent praktiske udfordringer med medicineringen udfordres vi af de fysiologiske mekanismer, der ligger til grund for de kroniske nociceptive og neuropatiske smerter. Neuropatiske smerter kan være meget svære at behandle tilfredsstillende, da skaderne på nerverne medfører irreversible ændringer i nervesystemet. Ændringerne sker på alle niveauer i det nociceptive system. For bedre at kunne håndtere konsekvenserne af disse ændringer, som fysiologisk adskiller sig væsentligt fra mekanismerne bag akutte smerter, følger en kort gennemgang af mekanismerne bag akutte smerter.
| Termologier og forkortelser | |
| Aδ-fibre | Tynde, myeliniserede afferente fibre involveret i smertetransmission. |
| Allodyni | Smerte, som udløses af et stimulus, der normalt ikke medfører smerte |
| AMPA receptor |
α-amino-3-hydroxy-5-methyl-4-isoxazol propionsyre - en glutamat-subtype receptor. |
| BDNF | Brain Derived Neurotrofisk Faktor - en vækstfaktor, der stimulerer og styrer neurogenese. |
| C-fibre |
Tynde, ikke-myeliniserede afferente fibre involveret i smertetransmission CGRP
|
| CGRP | Calcitonin Gen Relateret Peptid - et neuropeptid involveret i smerte. |
| Dysæstesi | En spontan eller udløst ubehagelig, abnormal følelse. Både allodyni og hyperalgesi (øget smerte, som udløses af et stimulus, der normalt medfører smerte) kategoriseres som dysæstesi. |
| GABA | Gamma-amino smørsyre - en inhibitorisk neurotransmitter. |
| Neuropatiske smerter | Opstår som følge af en sygdom eller læsion i det perifere eller centrale nervesystem. |
| NGF | Nerve Growth Faktor - en vækstfaktor primært involveret i reguleringen af vækst, vedligeholdelse og proliferation af neuroner. |
| NMDA receptor |
N-methyl-D-aspartat - en glutamat-subtype receptor. |
Akutte smertemekanismer
I det normalt fungerende nervesystem opstår akutte smerter som følge af et smertevoldende stimulus, inflammation og vævsbeskadigelse. De frie perifere nerveender aktiveres, og der udløses et aktionspotentiale, som medieres via primære afferente Aδ- og C-fibre. De afferente fibres cellekroppe ligger i dorsalrodsgangliet, og de synapser med sensoriske modtagerneuroner i rygmarvens dorsalhorn. I rygmarven moduleres det nociceptive signal af både inhibitoriske GABA interneuroner og descenderende baner fra hjernen og hjernestammen. Signalet videreformidles til blandt andet hjernestammen, thalamus og sensorisk cortex, hvor intensiteten og lokalisationen af smerten opfattes og processeres.
Perifer sensibilisering
Det normalt fungerende nervesystem har en evne til at omstille sig afhængigt af smertens intensitet og varighed. Denne omstillingsevne kaldes neuroplasticitet. Ved vævsbeskadigelse, hvor aktiveringen af de perifere nerveender pågår igennem længere tid, sker der ændringer i både det beskadigede og omkringliggende væv. De frie nerveender og primære afferente fibre bliver hyper-ekscitable. Det betyder, at deres membransensitivitet sænkes, så aktionspotentialer udløses hurtigere og oftere. De frie nerveender bliver altså mere følsomme og responderer kraftigere på stimuli. Resultatet er føleforstyrrelser.
Føleforstyrrelserne indbefatter primær og sekundær hyperalgesi samt allodyni (smerte, som udløses af et stimulus, der normalt ikke medfører smerte) både i det beskadigede og omkringliggende væv.
Central sensibilisering
Sideløbende med udviklingen af de perifere neuroplastiske forandringer sker der en central sensibilisering som følge af øget input fra de hyper-ekscitable perifere frie nerveender og afferente nervefibre. Modtagerneuronerne i rygmarven får en sænket membransensitivitet, ekscitatoriske receptorer opreguleres i antal, og GABA-interneuronerne ændres fra at have inhibitoriske til ekscitatoriske egenskaber. I hjernen opstår nye modtageområder for sensoriske inputs, og den descenderende modulation svækkes. Resultatet af den perifere og centrale sensibilisering er et over-følsomt, hyper-ekscitabelt nervesystem med lavere fyringstærskler og øget respons på stimuli.
De neuroplastiske forandringer, der er forbundet med akutte smerter, er reversible. Når vævsbeskadigelsen er helet, og inflammationen er ophørt, normaliseres nervesystemet og smerten forsvinder.
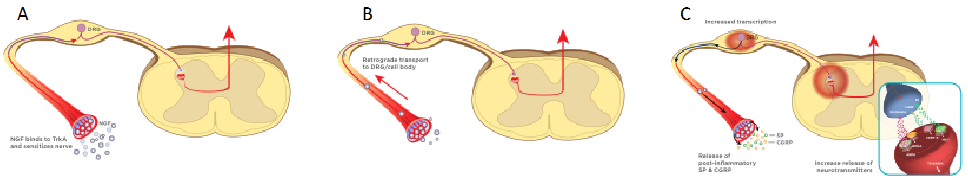
Figur: (A) NGF producers og frigives i perifært væv som følge af vævsbeskadigelse. Vækstfaktoren binder sig til den specifikke TrkA-receptor på frie nerveender. (B) NGF-TrkA-komplekset bliver optaget over cellemembranen og transporteres til den afferente fibers cellekrop i dorsalrodsgangliet (DRG). I dorsalrodsgangliet initierer NGF-TrkA-komplekset blandt andet en opregulering af både overfladereceptorer involveret i nociception og de proinflammatoriske mediatorer SP og CGRP. Resultatet er perifer sensibilisering. (C) Binding af SP og CGRP til deres specifikke receptorer medfører hyper-depolarisering af interneuronerne i dorsalhornet. NMDA-receptorerne potenseres og resultatet er wind-up og central sensibilisering. (Modificeret og gengivet med tilladelse fra Dr. Duncan Lascelles, Translational Research in Pain Program, Comparative Pain Research and Education Center, North Carolina State University).
Kroniske smerter
Kroniske smerter adskiller sig fra akutte smerter på en række punkter. Det er smerter, som fortsætter længere end forventet. De tjener ikke noget gavnligt biologisk formål og opretholdes på grund af patologiske forandringer i nervesystemet. Forandringerne er irreversible og skyldes følgerne af den perifere og centrale sensibilisering. Der sker blandt andet et tab af inhibitoriske interneuroner i dorsalhornene.
Celletabet opstår som følge af den kontinuerlige og øgede frigivelse af ekscitatoriske transmittersubstanser fra primære afferente nervefibre. Processen kaldes ekscitotoksicitet. I tillæg ændres GABA-interneuronernes fænotype permanent fra inhibitorisk til ekscitatorisk. Den hyper-ekscitable tilstand spredes ydermere fra afficerede til raske områder af centralnervesystemet. Resultatet er allodyni, dysæstesi (en ubehagelig, abnorm følelse udløst ved berøring), føleforstyrrelser og såkaldte eftersensationer, hvor smerte og ubehag fortsætter i en kortere eller længere periode efter en berøring eller et smertevoldende stimulus.
Smertestillende præparater til reduktion af perifer og central sensibilisering
Med udgangspunkt i de ovenfor beskrevne smertemekanismer følger herunder en kort gennemgang af smertestillende præparater, som kan anvendes til reduktion af den perifere og centrale sensibilisering. Størstedelen af de underliggende årsager til kroniske nociceptive smerter har en inflammatorisk komponent. En væsentlig faktor i tilgangen til reduktion af den perifere sensibilisering er derfor at reducere inflammationen. Til dette formål viser undersøgelser, at vores valg i 70-80 % af tilfældene falder på non-steroid antiinflammatorisk præparater (NSAIDs) (10, 11).
Tabel 1. Oversigt over udvalgte ikke-veterinært indregistrerede centralt virkende analgetika. BID: 2 x dagligt. TID: 3 x dagligt.
| Centralt virkende analgetika |
| Dosis (anekdotisk ) (mg/kg) |
| Hund | Kat | Bivirkninger og kommentarer | |
| Gabapentinoider | Sedation, somnolens, ataxi og polyfagi 2 - 10 dage efter opstart på behandling og ved dosis-opjustering. Der er hos mennesker ikke konstateret forhøjede lever- og nyreparametre ved langtidsbrug. Kan kombineres med NSAIDs, tricycliske antidepressiva og opioider i lav dosis. | ||
| Gabapentin | 10-20 (60) TID | 5-10 (30) TID | |
| Pregabalin | 1-4 (40) BID | 1-2 (10) BID | |
| NMDA-receptor antagonister | |||
| Amantadin | 2-5 (14) SID / BID | 2-5 SID / BID | Diarré og flatulens de første dage efter opstart på behandling. Ved høje doser tegn på angst, rastløshed og tørre slimhinder. |
| Tricycliske antidepressivae | |||
| Amitriptylin | 1-4 mg/kg SID / BID | 1-2 mg/kg (10–12,5 mg pr. kat) SID / BID | Tørre slimhinder, konstipation og urinretention. Alvorlige bivirkninger af central, autonom og neuromuskulær karakter hvis patienten udvikler serotonin-syndrom. Opstår hyppigst ved kombinationsbehandling med opioider og tramadol, serotonin-receptor antagonister, selektive serotonin genoptaks inhibitorer og antidepressiver af monoamin-oxidase-inhibitor typen. |
NSAIDs
I Danmark er der indregistreret fem NSAIDs til daglig PO-behandling af hunde og to til katte med inflammation og smerter forbundet med muskulo-skeletale lidelser. Fælles for de fleste NSAIDs er, at de blandt andet hæmmer prostaglandin-syntesen og dermed reducerer prostaglandin E2 (PGE2), som spiller en stor rolle i sensibiliseringen af de frie nerveender. Prostaglandin-syntesen reduceres ved at hæmme COX1- og COX2-enzymernes aktivitet i arachidonsyrekaskaden, som induceres ved vævsbeskadigelse.
NSAIDerne adskiller sig dog også fra hinanden på nogle punkter. Blandt andet har de forskellig COX1- og COX2-selektivitet og varierende bivirkningsprofiler. Sikkerheden og bivirkningerne ved langtidsbrugen af NSAIDs til hunde og katte er for de fleste præparaters vedkommende godt beskrevet, og der henvises derfor til de senest publicerede reviews om antiinflammatorika generelt, om langtidsbrugen af NSAIDs til katte med nedsat nyrefunktion samt om langtidsbehandling af hunde med OA (12-14).
EP4-receptor-antagonister
Grapiprant er et veterinært indregistreret non-COX-inhiberende, non-steroid antiinflammatorisk præparat, som selektivt blokerer PGE2s-specifikke EP4-receptor. Blokering medfører, at PGE2 ikke kan aktivere den signalkaskade, der normalt medierer inflammation og bidrager til perifer sensibilisering. Til forskel fra de COX-inhiberende NSAIDs udøver grapiprant sin anti-inflammatoriske effekt uden at inhibere syntesen af prostaglandiner, hvorved den vaskulære homeostase, gastroprotektionen og nyreperfusionen opretholdes. Præparatet er indregistreret til daglig PO-behandling af hunde med smerter som følge af OA. To publicerede studier rapporterer henholdsvis den smertestillende effekt og sikkerheden af grapiprant hos hunde med naturligt forekommende OA (15, 16). De hyppigst rapporterede bivirkninger var milde GI-symptomer (vomitus, diarré og lind afføring), og der blev ikke påvist nogen medicin-relaterede ændringer i leverværdier, UREA, CREA og thrombocyt-funktion.
Behandlingen med et NSAID eller en EP4-receptor antagonist virker også på spinalt niveau. Hér modvirkes blandt andet den PGE2-inducerede aktivering af mikroglia og inhiberingen af den descenderende modulation. Er den smertestillende effekt af antiinflammatorisk monoterapi ikke tilstrækkelig, vil kombinationer med andre typer af smertestillende, som i højere grad reducerer den centrale sensibilisering være næste skridt i behandlingsstrategien. Denne strategi baseres på humane internationale behandlingsguidelines, som er resultatet af systematiske reviews af store mængder data fra kontrollerede kliniske forsøg (17). Hér foreligger god evidens for anvendelsen af en række centralt virkende analgetika, herunder gabapentinoider, NMDA-antagonister og tricycliske antidepressivae til reduktion af den centrale sensibilisering. Til gengæld er effekten af både de potente rene opioid μ-agonisters og tramadol moderat ved behandling af kroniske nociceptive smerter og manglende ved behandling af neuropatiske smerter. Herunder følger en oversigt over veterinært relevante data for anvendelsen af de fire typer af smertestillende i klinisk smådyrspraksis.
Gabapentinoider
Gabapentinoiderne er førstevalg i behandlingen af neuropatiske smerter hos mennesker (17). De to humant indregistrerede antiepileptiske præparater gabapentin og pregabalin har i tillæg til deres antikonvulsive effekt også vist sig at have smertestillende og anxiolytisk effekt (18). Den smertestillende effekt opnås især ved binding til spændingsafhængige calcium-kanaler i centralnervesystemet, hvorved mængden af frigivne ekscitatoriske neurotransmittorer reduceres.
Hos hunde og katte har både gabapentin og pregabalin en god biotilgængelighed og kan gives både med og uden foder. Gabapentins halveringstid er kort, hvilket betyder, at dosering tre gange i døgnet ofte er nødvendig for at opretholde en sufficient smertestillende plasmakoncentration (19, 20). Den smertestillende effekt af gabapentin hos hunde og katte med kroniske nociceptive og neuropatiske smerter er rapporteret i to prospektive kliniske studier og en række casereports (21-28). Det aktive stof kan udskrives både som tabletter og i kapselform. Den mindste kapsel indeholder 300 mg, hvilket vanskeliggør korrekt dosering særligt til de små patienter. Alternativt kan kapsler á 100 mg hjemtages på enkeltdyrstilladelse.
Sammenlignet med gabapentin har pregabalin en række fordele. Den væsentligt længere halveringstid muliggør, at dosering to gange i døgnet er tilstrækkelig for at opnå sufficient smertestillende plasmakoncentration. Den smertestillende effekt af pregabalin er dokumenteret i tre kontrollerede, kliniske studier hos hunde (29-31) og beskrevet i en caserapport hos to katte med kroniske nociceptive og neuropatiske smerter (32). Pregabalin kan udskrives i kapselform eller som oral opløsning, hvilket muliggør nøjagtig dosering af selv meget små patienter.
NMDA-receptor-antagonister
Amantadin er en NMDA-receptor.antagonist med samtidig agonistisk effekt på dopaminerge og antagonistisk effekt på nicotinerge receptorer. Amantadin kan anvendes som add-on i en multimodal behandling i kombinationen med NSAIDS, et gabapentinoid og/eller et opioid. Den smertestillende effekt er rapporteret i et kontrolleret klinisk studie på hunde med OA og i én case med neuropatiske smerter (33, 34). Hos katte med OA er en positiv effekt målt på ejer-rapporteret forbedret mobilitet og øget livskvalitet, men også væsentligt reduceret aktivitetsniveau beskrevet ved monoterapi med amantadin (35).
Halveringstiden er relativt lang, og den smertestillende effekt indtræder først adskillige uger efter behandlingsopstart ved dosering én gang dagligt. Det anbefales derfor at dosere to gange i døgnet for at opnå sufficient smertestillende plasmakoncentration.
I Danmark er der indregistreret et enkelt humant præparat, som indeholder 100 mg amatadin pr. kapsel, hvilket vanskeliggør korrekt dosering særligt til de små patienter. Det er muligt at hjemtage en oral suspension 10 mg/ml på enkeltdyrstilladelse. Vær dog opmærksom på, at smagen kan afholde nogle patienter fra at acceptere PO-behandling med den orale suspension.
Tricycliske antidepressiva
De tricycliske antidepressivaes smertestillende effekt udøves primært via præsynaptisk inhibering af genoptagelsen af serotonin og noradrenalin. Reduktionen i central sensibilisering sker derfor hovedsageligt som resultat af en øget descenderende inhibering. Blandt de humant indregistrerede tricycliske antidepressiver er anvendelsen af amitriptylin til behandling af neuropatiske smerter hos hunde og katte mest omtalt. I casestudier beskrives god effekt af monoterapi med amitriptylin hos hunde med formodede neuropatiske smerter (28, 36). Der foreligger anekdotiske rapporter om amitriptylins smertestillende effekt hos katte (21, 37, 38).
Opioider
Opioider reducerer både perifer og central sensibilisering, idet opioid-receptorerne findes både perifert på de sensoriske afferente nervefibre og centralt på neuroner i rygmarvens dorsalhorn og i hjernen. Den smertestillende effekt er et resultat af nedsat frigivelse af ekscitatoriske neurotransmittorer og hyperpolarisering af nervernes membraner. Brugen af injektionspræparater med rene μ-agonister (fx metadon og fentanyl) til familiedyr med akutte smerter er effektiv, sikker og medfører sjældent bivirkninger.
I lighed med vores viden fra humane studier rapporteres der hos familiedyr med kroniske nociceptive smerter manglende eller i bedste fald ringe effekt, og neuropatiske smerter er refraktære overfor PO-behandling med opioider (17, 37, 39). Den manglende effekt skyldes primært en lav biotilgængelighed (se tabel 2), dårlig absorption, kort halveringstid og stor variation mellem individer og racer med hensyn til produktionen af aktive metabolitter (40, 41).
Tramadol, en syntetisk, lav-potent codein-analog, er det eneste veterinært indregistrerede morfin-lignende præparat til PO-behandling af lette smerter i bløddele og bevægeapparatet hos hunde. I tillæg til en svag μ-receptor-agonisme inhiberer tramadol også den præsynaptiske optagelse af serotonin og noradrenalin.
Tramadols analgetiske effekt hos hunde er undersøgt i tre kliniske studier, hvoraf ét er placebokontrolleret (26, 42, 43). Der rapporteres en fraværende klinisk effekt af tramadol som monoterapi og en begrænset effekt, når tramadol kombineres med NSAIDs eller prednisolon. Hyppigt forekommende bivirkninger er sedation eller dysfori, ataksi, semi-anoreksi, vomitus og konstipation eller diarré. Hos katte med OA er en positiv effekt i form af øget aktivitetsniveau og forbedret livskvalitet ved monoterapi med tramadol rapporteret i to placebokontrollerede kliniske studier (44, 45). Syv af 24 inkluderede katte (29 %) udgik dog af det ene studie før tid grundet bivirkninger i form af eufori, dysfori, sedation, semi-anrexi og diarré.
Tabel 2. Opioiders biotilgængelighed ved peroral behandling. (1) Efter buccal administration. (2) Ikke-detektérbar ved en dosis på 2 mg/kg PO. (3) Samtidig inhibitor af noradrenalin-genoptag. (4) Samtidig inhibitor af serotonin- og noradrenalin-genoptag. Obs: deles depot-tabletter, ændres den optagne mængde af aktivt stof væsentligt, og risikoen for overdosering og bivirkninger øges.
| Opioiders biotilgængelighed |
| Hund | Kat |
| Rene μ-agonister | ||
| Codein | ∼ 4 % | N/A |
| Hydromorfon | < 10 % | ∼ 2 % (1) |
| Ketobemidon | N/A | N/A |
| Metadon | N/A (2) | ∼ 30 % (1) |
| Morfin | < 20% | ∼ 0,4 % (1) |
| Oxycodon | N/A | N/A |
| μ-agonister med andre samtidige virkningsmekamismer | ||
| Tapentadol (3) | ∼ 4 % | N/A |
| Tramadol (4) | ∼ 20 % | ∼ 60 % |
Hvad bringer fremtiden?
De seneste år har der været en stagnation i udviklingen af nye smertestillende præparater. Den prækliniske forskning rapporterer løbende nye aktive substanser med god smertestillende effekt, når substanserne undersøges i relevante dyremodeller. Desværre er den smertestillende effekt ikke i samme grad sufficient, når substanserne afprøves i tidlige kliniske forsøg på mennesker med kroniske smerter. Konsekvensen er, at kun ét ud af 10 nye potentielle analgetika i øjeblikket opnår godkendelse til at blive markedsført.
Derfor er det også interessant, at der for nyligt er blevet indregistreret et nyt præparat til behandling af hunde med smerter forbundet med OA. Præparatet er et monoklonalt antistof, som er fremstillet til specifikt at neutralisere vækstfaktoren Nerve Growth Factor (NGF). NGF er opreguleret i ledvæsken hos hunde med OA og produceres af beskadigede chondrocytter, synovialmembranen og immunreaktive celler, særligt mastceller (46, 47). Som beskrevet i faktaboksen og figur 1 spiller NGF en rolle i den perifære og sandsynligvis også den centrale sensibilisering. Præparatet administreres subcutant med 28 dages mellemrum grundet antistoffets lange halveringstid på mellem ni og 16 dage (48, 49). Den smertestillende effekt af anti-NGF monoklonale antistoffer hos hunde med naturligt forekommende OA er rapporteret i to publicerede kliniske studier (50, 51). Den hyppigst rapporterede bivirkning er mild reaktion ved injektion (hævelse og varme) samt et ikke-klinisk relevant fald i PCV (packed cell volume) 28 dage efter første injektion (49, 50).
Konklusion og perspektivering
Familiedyrenes position i familien har ændret sig igennem årene. Med den ændrede position følger et øget fokus på velfærd og god livskvalitet. Forekomsten af aldersbetingede lidelser inklusive OA og andre årsager til kroniske smerter øges i takt med en stigende levealder. Som en naturlig følge øges behovet for og efterspørgslen på bedre og mere effektiv behandling af den kroniske smertepatient. Vi kan sammensætte en multimodal protokol baseret på vores viden om de underliggende smertemekanismer, men hvordan måler vi behandlingssucces?
Smerte er subjektiv, opleves forskelligt mellem individer og kan ikke kvantificeres objektivt. Dyrets ejer kommer derfor i væsentlig grad til at stå for vurderingen af behandlingseffektiviteten. En afklaring af, hvilke målbare parametre det er vigtigt for ejeren at optimere, og som samtidig kan bruges til at evaluere en effekt af behandlingen, inden den igangsættes, vil være afgørende for at opnå succes. Målet med at igangsætte en multimodal kronisk smertebehandling vil være at opnå den bedst mulige smertelindring inden for kortest mulig tid med et minimum af bivirkninger til følge. Kan vi ikke opnå en tilfredsstillende behandlingseffekt, er eutanasi altid et værdigt og reelt alternativ.








