En del tumorer og neoplastiske tilstande hos hunde og katte kan tentativt diagnosticeres ved hjælp af et finnålsaspirat, hvilket gør det muligt at planlægge relevant staging og behandling. I andre tilfælde kan det være nødvendigt at udtage en vævsprøve til histopatologisk vurdering. Der findes dog også tilfælde, hvor cytologi og/eller histopatologi ikke kan stille en endelig diagnose alene, eller hvor de ikke er de mest optimale metoder at anvende.
Vigtigheden af at opnå en præcis diagnose hos patienter med neoplastiske tilstande stiger i takt med, at antallet af behandlingsmuligheder øges, og vi får mere viden om, hvordan de specifikke cancertyper behandles bedst. For nogle patienter vil det være nok at afgøre, om der er tale om en malign tumor eller ej, for at eventuel behandling kan besluttes. For andre patienter vil det være vigtigt, at cancertypen subtypes på molekylært niveau, før man kan udvælge den mest optimale behandling.
Denne artikel er den anden i en artikelserie om cancer hos familiedyr. Den gennemgår nogle af de tilgængelige avancerede diagnostiske metoder, man som kliniker i familiedyrspraksis kan gøre brug af for at differentiere mellem forskellige cancertyper eller fastslå en cancerdiagnose. Derudover er der en kort gennemgang af de cancer-screeningstests, som pt. er tilgængelige på det veterinære marked.
Specialfarvning af celler og væv
Specialfarvninger har grundlæggende til formål at differentiere mellem celletyper. De bruges derfor, når man allerede har afgjort, at læsionen er neoplastisk, og om den er benign eller malign, men hvor der er tvivl om, hvilken celletype neoplasien er udgjort af.
Princippet for cyto- og histokemiske specialfarvninger er, at det cytologiske eller histologiske præparat farves med et stof, som reagerer kemisk med elementer i celler eller væv. Et hyppigt anvendt eksempel på en kemisk farvning er »toluidinblå«, som reagerer med mukopolysakkarider i blandt andet mastcellers granula. Derfor bruges toluidinblå især i de tilfælde, hvor mastcellerne er udifferentierede og dermed svære at genkende i præparatet.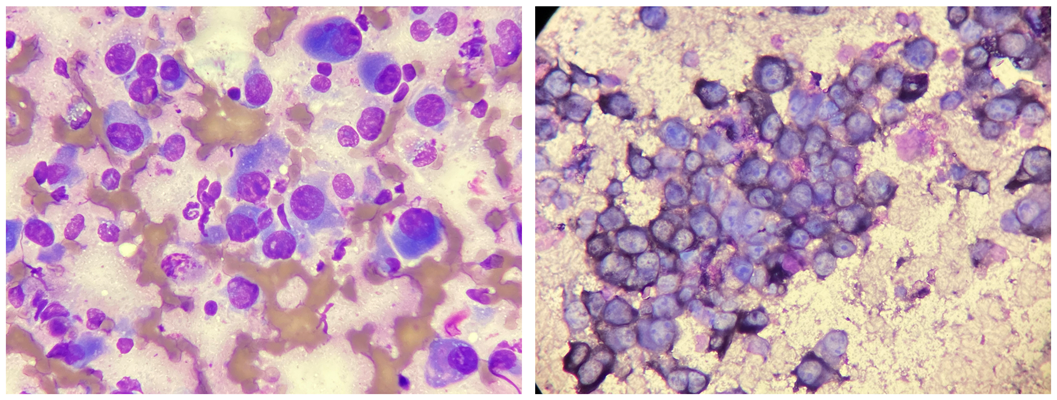
Cytologi af nåleaspirat fra mistænkt osteosarkom farvet med hæmacolor. Samme cellepopulation farvet med hæmacolor og efterfølgende eksponeret for Nitroblue tetrazolium chloride/5-bromo-4-chloro-3- indolyl fosfat toluidine salt, som er et substrat for basisk fosfatase. Cellernes basiske fosfatase reagerer med substratet,hvilket resulterer i en lokal farvedeponering.
Andre hyppigt brugte mastcellefarvninger er »giemsa« og »ny methylenblå« (1). Et eksempel på en kemisk farvning, som kun bruges til cytologiske præparater, er en »alkalisk fosfatase (ALP) farvning«. Denne bruges til at skelne osteosarkomer fra andre mesenkymale knogletumorer. Her farves med et substrat for ALP, hvilket findes i høj koncentration i knogleproducerende læsioner (2). Dette betyder, at hvis man har et cytologisk præparat fra en malign mesenkymal tumor lokaliseret i en knogle, men er i tvivl om, hvorvidt det er et osteosarkom eller eksempelvis et kondrosarkom, kan man lave en såkaldt ALP-farvning. Såfremt de maligne celler er positive for farvningen, indikerer det, at læsionen er osteoidproducerende og sandsynligvis et osteosarkom.
Sensitiviteten af ALP-farvning til at skelne osteosarkomer fra andre knogletumorer er beskrevet som op til 100 procent, mens specificiteten er 89 procent (2,3). Det vil sige, at farvningen kan være falsk positiv, men sjældent falsk negativ.
Immunocytokemiske (ICC) og immunohistokemiske (IHC) farvninger er baseret på antistof-antigen bindinger. Her farves med et primært antistof, som binder til det antigen, man er interesseret i at påvise (se Figur 1). Dernæst farves med et sekundært antistof, som er specifikt for det primære antistof og samtidig bærer et enzym, der fremkalder en farvereaktion. Denne farvereaktion vil være synlig ved almindelig lysmikroskopi, og såfremt farvereaktionen er til stede i præparatet, viser det, at det interessante antigen er udtrykt i cellerne eller vævet.
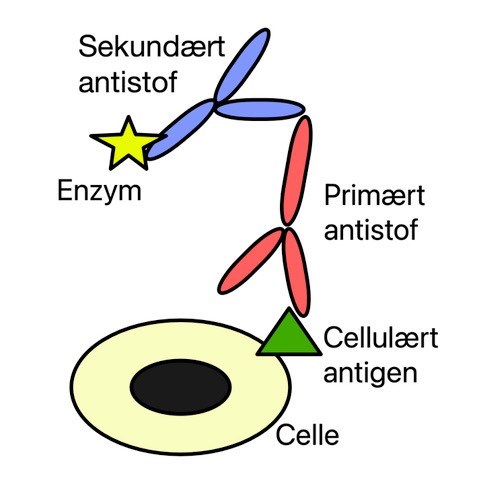
Figur 1. Princippet for immunohistokemi. Et primært antistof binder til det cellulære antigen, der undersøges for. Herefter tilføjes et sekundært antistof, som
er specifikt for det primære antistof. Det sekundære antistof bærer et enzym, som katalyserer et farveskifte, der kan detekteres med lysmikroskopi.
Det pågældende antigen skal være specifikt for en bestemt celletype, da formålet med metoden er at afgøre, hvilke celler canceren består af (se Tabel 1). Eksempelvis udtrykker T-lymfocytter CD3, der er en del af T-celle-receptoren, mens B-lymfocytter udtrykker CD79a, som er associeret med B-cellens antigenreceptor (4). ICC eller IHC med farvning for CD3 og CD79a kan derfor afgøre, om patienten har malignt lymfom af B- eller T-celle ophav. Hvis man fx har brug for at afgøre, om en tumor er et karcinom eller et sarkom, kan man udnytte, at epitheliale tumorer generelt udtrykker antigenet cytokeratin, der er en del af cytoskelettet i epitheliale celler, mens mesenkymale tumorer udtrykker vimentin, der er et strukturelt protein i mesenkymale celler (5).
Generelt udføres ICC kun i begrænset omfang, hvorimod de fleste større patologilaboratorier har mulighed for at udføre IHC. Ofte vil patologen komme med en anbefaling i histopatologirapporten, hvis det umiddelbart er relevant at udføre IHC samt nævne, hvilke markører, det er indiceret at bruge. Som kliniker er det dog vigtigt, at man kan tage stilling til, om resultaterne fra IHC vil have betydning for patientens behandling og opfølgning, og dermed om det er klinisk relevant at udføre testen.
Tabel 1. Almindeligt brugte immunohistokemiske markører til cancerdiagnostik hos hund.
| Markør/panel | Celletype(r) / cancertype |
| Cytokeratin | Epitheliale celler / karcinom |
| Vimentin | Mesenchymale celler / sarkom |
| Faktor8/vWF-associeret protein + CD31 | Endothel / hæmangiosarkom |
| Melan-A + S100 + PNL2 + TRP1/2 | Melanocytter / melanom |
| CD18 + iba-1 | Histiocytter / histiocytært sarkom |
| CD79a + PAX5 | B-lymfocytter / B-celle malignt lymfom |
| CD3 | T-lymfocytter / T-celle malignt lymfom |
| MUM1 | Plasmaceller / plasmacytom og multipelt myelom |
| CD117/KIT | Mastceller / mastcelletumorer |
| Desmin | Muskelceller / rhabdomyosarkomer og leiomyosarkomer |
| Smooth-muscle actin | Glat muskulatur / leiomyosarkomer |
| Myoglobin | Skeletmuskel / rhabdomyosarkomer |
Bemærk, at listen ikke er udtømmende, og at flere celletyper end de nævnte kan udtrykke den pågældende markør.
Flowcytometri
Flowcytometri er en metode til at analysere enkeltceller, der kan grupperes efter fx størrelse, granularitet og udtryk af specifikke antigener (6). Apparatur, som bruges til analyse af hæmatologiske profiler, vil typisk være en form for flowcytometre, om end de er mere simple end de maskiner, der bruges i avanceret cancerdiagnostik.
Flowcytometri bruges især til at diagnosticere og karakterisere malignt lymfom og leukæmi, hvor materialet enten er en blodprøve eller et lymfeknude-finnålsaspirat resuspenderet i et transportmedie. Ligesom ved ICC og IHC udnyttes antistof-antigen-bindinger. Inden analyse blandes cellerne med specifikke antistoffer bundet til en fluorofor. Hvis cellerne udtrykker det relevante antigen, vil antistofferne med fluoroforen bindes hertil, ellers fjernes antistofferne ved vask inden analyse. Herefter kan flowcytometeret detektere tilstedeværelse af fluoroforen og dermed, om cellerne i prøven udtrykker antigenet.
Den mest almindelige veterinære indikation for flowcytometri er immunofænotypning af patienter, som allerede er diagnosticeret med lymfom på cytologi. Her anvendes specifikke antistoffer mod molekyler på henholdsvis B- og T-lymfocytter for at afgøre, om patienten har B- eller T-celle lymfom.
Flowcytometri kan desuden også bruges til at skelne mellem stadie V malignt lymfom med knoglemarvsinvolvering og akut leukæmi via udtryk af CD34, som er en stamcellemarkør, der indikerer akut leukæmi, og til at skelne mellem myeloid og lymfoid akut leukæmi (6). Det er påvist, at thymomer har en højere andel af lymfoide celler, der udtrykker både CD4 (T-hjælpeceller) og CD8 (cytotoksiske T-celler) antigener samtidigt, sammenlignet med mediastinalt malignt lymfom. Flowcytometri kan derfor potentielt også bruges til at skelne mellem disse to differentialdiagnoser for tumorer i craniale mediastinum (7).
Ved brug af blandt andet flowcytometri har man identificeret subtyper af multicentrisk malignt lymfom, som er indolente og har en prognose, der adskiller sig væsentligt fra andre typer af lymfom (8). T-zone lymfom er en subtype med en særlig flowcytometrisk profil, hvor en lang overlevelse kan ses selv uden behandling med kemoterapi (9). Vi lærer langsomt mere og mere om lymfom og leukæmi og de forskellige subtyper, som gør, at vi med tiden bliver bedre til at målrette vores behandling til de enkelte patienter, blandt andet baseret på deres flowcytometriske profil.
Veterinært Diagnostisk Laboratorium på Københavns Universitet er pt. det eneste danske laboratorium, der tilbyder flowcytometri til veterinære patienter. Det er dog også muligt at sende prøver med kurer til udenlandske laboratorier, forudsat at prøven er fremme inden for cirka 24 timer. Det anbefales at kontakte det specifikke laboratorium, uanset om det er i Danmark eller udlandet, for at få vejledning inden prøven udtages.

PARR: PCR for Antigen Receptor Rearrangements
PARR er en PCR-baseret metode til at afgøre, om lymfoide celler i en prøve er mono- eller polyklonale. Hvis cellerne er monoklonale, altså alle er udviklet fra den samme celle, indikerer det neoplasi, mens polyklonalitet repræsenterer den normale diversitet, man kan observere i en lymfoid-cellepopulation (10). Under T- og B-lymfocytters udvikling vil gensegmenter i den variable del af henholdsvis T-cellereceptoren og immunoglobulinreceptoren rearrangeres, og de får derved forskellige sekvenser og længder fra celle til celle. Ved PARR udføres kvantitativ PCR, hvor PCR-primerne er målrettet mod de konstante regioner, som omgiver den variable region i DNA’et, der koder for receptorerne. Dette resulterer i PCR-produkter, som er af forskellig længde baseret på DNA sekvensen. Celler, som er monoklonale, vil have samme størrelse af deres PCR-produkt, og vil derfor give et ensartet signal.
PARR kan bruges til at subtype et diagnosticeret lymfom som enten T- eller B-celle lymfom, men i modsætning til flowcytometri får man ikke detaljeret information om andre markører med mulighed for en mere detaljeret subtypebestemmelse. PARR bruges især til at be- eller afkræfte en mistanke om malignt lymfom eller lymfoid leukæmi (11).
PARR kan dog ikke stå alene som diagnostisk metode, da både falsk positive og falsk negative resultater er relativt almindelige, især hos kat. Derfor udføres PARR primært som tillæg til cytologi eller histologi.
Hos kat bruges PARR oftest til at skelne mellem lavgradigt alimentært lymfom og inflammatorisk tarmsygdom, hvilket kan være svært på histopatologi alene (12). Sensitiviteten af PARR for at diagnosticere felint alimentært lymfom er rapporteret i området 70-87 procent og specificiteten til 60-90 procent (13–15).
Hos hund kan PARR bruges til at skelne de fleste former for malignt lymfom fra lymfocytære inflammatoriske lidelser med varierende sensitiviteter og specificiteter afhængigt af anatomisk subtype og immunofænotype. I to nyere studier er sensitiviteten og specificiteten af PARR hos hund dog fundet til at være henholdsvis 86,5-100 procent og 98,7-100 procent (16,17).
Hos både hund og kat er det vigtigt, at resultatet af PARR evalueres sammen med de øvrige kliniske- og parakliniske fund.
PARR kan udføres på det paraffinindstøbte materiale, som patologilaboratoriet allerede har liggende, men det er også muligt at udføre PARR på eksempelvis cytologiske præparater og i effusioner og EDTA-blodprøver med et højt celletal.
BRAF
En anden PCR-baseret metode er den relativt nye BRAF-mutationstest. Her udnyttes, at tumorvævet fra 80-85 procent af hunde med overgangsepithelcellekarcinomer i urinvejene (TCC/UCC) bærer en specifik mutation i exon 15 af BRAF-genet (18,19). Denne mutation forårsager en ændring i aminosyrenummer 595 i BRAF-proteinet, som ændres fra valin til glutamin, hvilket betegnes p.V595E.
BRAF er et onkogen, og mutationen forårsager et overaktivt protein, som fremmer cancerens udvikling. V595E-mutationen kan detekteres i det tumor-DNA, som findes i urinen fra hunde, hvis tumorvæv bærer mutationen. Det betyder, at man non-invasivt kan stille diagnosen TCC/UCC hos hund ved hjælp af en urinprøve, og således kan man i udvalgte cases undgå at skulle tage invasive cytologiske eller histologiske prøver fra tumor. Et positivt resultat fortæller dog ikke, om tumor sidder i prostata, urethra eller urinblæren, hvorfor testen som minimum bør kombineres med billeddiagnostiske undersøgelser, så som ultralyd.
BRAF-testen er 80-85 procent sensitiv, hvilket skyldes, at tumorcellerne i 15-20 procent af TCC/UCC-cases ikke bærer den specifikke BRAF-mutation. Testen regnes dog som næsten 100 procent sensitiv hos de patienter, hvis tumorvæv bærer V595E-mutationen, og som næsten 100 procent specifik, da mutationen ikke er detekteret i urin hos patienter uden TCC/UCC (20). Det vil sige, at hvis testen er positiv hos en patient med en tumor i urinvejene eller prostata, kan testen stille diagnosen TCC/UCC, men såfremt den er negativ, kan man ikke udelukke TCC/UCC, da der kan være tale om et TCC/UCC uden V595E-mutation.
Som en tilføjelse til BRAF-testen findes nu en udvidet BRAF-PLUS test. Denne kan anvendes hos patienter, som tester negativt på BRAF V595E-testen, hvor der er en fortsat mistanke om TCC/UCC. BRAF-PLUS testen undersøger for større strukturelle forandringer, som er forenelige med cancer, i cancercellernes genom (20). Ifølge udbyderne af testen, vil den være positiv i to tredjedele af de TCC/UCC-patienter, som tester negativ på standard BRAF-testen, om end det ikke har været muligt at finde publikationer, som understøtter dette på nuværende tidspunkt.
Cancerdiagnostik: Testpræstation
Formålet med noninvasive cancer screeningstests er generelt at bruge eksempelvis blod eller urin til at detektere cancer, inden patienten får kliniske tegn. Hermed vil chancen for et godt terapeutisk udfald potentielt forbedres. Dette kan især være relevant for specifikke racer, hvor man ved, at deres livstidsrisiko for at udvikle cancer er høj.
Ligesom ved al anden diagnostik er det dog vigtigt, at man har en god ide om testens sensitivitet og specificitet samt den positive- og negative prædiktive værdi (se Boks 1), så man kan udvælge hvilke screeningstests, der er relevante for den specifikke patient, samt vide, hvordan man skal fortolke testresultaterne. Det er især centralt at holde sig for øje, at testens positive- og negative prædiktive værdi påvirkes af sandsynligheden for sygdom i den patient, man tester. Det vil sige, at hvis man tester en patient med høj sandsynlighed for sygdom grundet relevant signalement og klinik, da vil den positive prædiktive værdi (PPV) stige, samtidigt med at den negative prædiktive værdi (NPV) falder. Omvendt, hvis man tester en patient med lav sandsynlighed for sygdom, fx i forbindelse med screening for en relativt sjælden lidelse, da vil PPV falde, mens NPV stiger.
Cancer screening: Proteinbaserede tests
Der har i en årrække været flere firmaer, som udbyder cancerscreeningstests baseret på måling af specifikke proteiner i serum. Fælles for disse tests er, at de enten måler en proliferationsmarkør, akutfaseproteiner eller begge dele.
Proliferationsmarkøren er et enzym, som hedder thymidinkinase 1 (TK1). TK1 er et enzym involveret i DNA syntese, og enzymets niveau er højest i S-fasen af celledeling. Niveauet af TK1 i serum er derfor generelt højt i tilstande med høj celledeling, hvilket især ses ved hæmatologiske maligne neoplasier, såsom malignt lymfom (22). TK1 kan dog også være forhøjet i ikke-neoplastiske tilstande som ved infektion og inflammation (23).
Af akutfaseproteiner måles typisk C-reaktivt protein (CRP) og/eller haptoglobin. CRP er et akutfaseprotein, som produceres i leveren grundet proinflammatoriske cytokiner, og niveauet af CRP i serum er derfor et mål for systemisk inflammation (24). Haptoglobin er også et akutfaseprotein, og et højt niveau er ligeledes et udtryk for systemisk inflammation (25). Nogle cancerlidelser, så som malignt lymfom, vil være associeret med en vis grad af systemisk inflammation, hvilket er baggrunden for at bruge akutfaseproteinerne til cancerscreening (26–28).
Der findes kun begrænsede mængder publiceret data, som viser, hvor god TK1 og CRP/haptoglobin er til cancerscreening, især hvis de bruges til at screene for andet end malignt lymfom. Derfor er det vigtigt at holde sig for øje, at de ikke er specifikke for maligne tilstande, og at de ikke nødvendigvis er forhøjede hos alle cancerpatienter (28). Relevansen af de proteinbaserede tests er derfor umiddelbart størst til monitorering for tidligt recidiv hos patienter, som tidligere er diagnosticeret og behandlet for malignt lymfom (29,30).
Cancerscreening: Genetiske tests
Udviklingen inden for gensekventeringsteknologien har bidraget til et skifte i cancerdiagnostikken fra måling af fx serum-proteiner til undersøgelse af cancer-DNA eller lignende i kropsvæsker som blod, urin, CSF eller effusioner. Populært bruges udtrykket »liquid biopsy«, altså »flydende biopsi«, om metoden, da man udvinder cancermateriale fra væsken, der kan bruges som en slags biopsi. Der er pt. to kommercielt tilgængelige liquid biopsy-tests i USA/Canada, som er baseret på at måle enten cellefrit-DNA eller DNA-associeret materiale i blodprøver fra hund. Årsagen er, at dette materiale kan frigives til blodet ved tilstande med højt celle-turnover, så som ved cancer. Værdien af disse tests til cancerscreening i en generel population af hunde uden åbenlys cancer, er dog ikke endeligt afgjort.
Udover liquid biopsy-baseret DNA-diagnostik findes der pt. flere firmaer, som tilbyder at sekventere hundens tumorvæv. Dette har til formål at kortlægge DNA-mutationer i tumorvævet med henblik på diagnostik, prognosticering og udvælgelse af målrettet terapi. Eksempelvis tilbyder Idexx USA/Canada dette via firmaet FidoCure (CA, USA). Kortlægningen af mutationer bruges til at foreslå, hvilken specifik behandling hunden skal have baseret på tumorens genetiske profil. Én af udfordringerne med dette er, at der findes meget få specifikke targeterede antineoplastiske lægemidler, som er undersøgt i hunde med cancer. Det vil sige, at for mange tumormutationer vil der kun findes humane lægemidler tilgængelige, som oftest enten er bekostelige, toksiske eller har begrænset effektivitet i hund.
Hvad byder fremtiden mon på?
Udviklingen i cancerdiagnostik har allerede bevæget sig fra overfladisk morfologi til mikroskopisk karakterisering og evaluering af proteinudtryk. I bølgen af den seneste udvikling inden for DNA-teknologi er karakterisering af cancercellernes arvemasse og de mutationer, som driver cancercellens udvikling, blevet en væsentlig del af human cancerdiagnostik. Disse tendenser begynder også at vinde ind på det veterinære marked. Med den teknologiske udvikling og de faldende priser inden for sekventeringsteknologi forventes det, at vi i fremtiden vil komme til at bruge denne type af teknologi som rutine til diagnostik og karakterisering af neoplastiske sygdomme hos veterinære patienter også.
Lige nu mangler vi dog klar evidens for, at avanceret screening og karakterisering af cancer giver en forbedring af den veterinære patients overlevelsesmuligheder og livskvalitet. Samtidigt mangler vi en forståelse for effekten af diverse genetiske mutationsprofiler. Eksempelvis ses de drivende mutationer hos hæmangiosarkomer hos hund også i benigne mammatumorer (36), hvilket er svært at forklare med vores nuværende viden om disse mutationer. Dette tydeliggør samtidigt, at udviklingen af cancer er mere kompleks, end hvad en mutationsprofil alene kan forudse.
Der er ingen tvivl om, at liquid biopsy-konceptet og de relaterede teknikker har et stort potentiale, når det kommer til noninvasiv cancerdiagnostik og -monitorering. Men til trods for at flere firmaer allerede udbyder disse tests kommercielt, mangler der stadig viden og udvikling, før det for alvor giver mening at implementere dem i det diagnostiske arbejde i familiedyrspraksis. Det er dog værd at holde øje med feltet, som med tiden kan revolutionere den måde, vi diagnosticerer cancer på.








