Hvorfor kan man ikke bare opdatere et produktresume? Det spørgsmål er stillet flere gange under blæsten omkring den nye veterinære lægemiddelforordnings artikel 106(1) – fordi der nu er sat en ekstra streg under, at et veterinært lægemiddel skal anvendes som præciseret i markedsføringstilladelsen og angivet i produktresumeet (Summary of Product Characteristics - SPC).
Danske dyrlæger udtrykker stor frustration og efterspørger opdateringer af produktresumeerne, specielt på dosis, behandlingshyppighed og længde, således at de fortsat kan anvende lægemidlerne, som de plejer, og med udgangspunkt i deres faglighed og ekspertise.
Men selv om spørgsmålet er lige så relevant, som frustrationen er stor, så er svaret p.t., at produktresumeerne ikke bare kan opdateres. For det er ikke en helt enkel procedure.
Enhver ændring kræver dokumentation
Produktresumeet indeholder basal information om lægemidlet, og hvordan dyrlæger og andre brugere bedst anvender det. Det er en kondenseret sammenfatning af alle de mange elementer, der indgår i godkendelsen af et lægemiddel – altså et dossier, der danner baggrund for hele godkendelsen, og som blandt andet indeholder dokumentation af sikkerhed for lægemidlet:
- I de dyr, produktet skal anvendes til
- For de personer, som skal håndtere produktet og
- For miljøet.
Dossieret indeholder dertil dokumentation af effekt – og for produktionsdyr tilbageholdelsestid om nødvendigt. Dokumentation af såvel sikkerhed som effekt er knyttet til den angivne dosis, behandlingshyppighed og længde – og SPC’et er udformet, så fordele ved lægemidlet optimeres, og eventuelle risici reduceres.
Hvis dosis, administrationshyppighed og/eller behandlingsvarighed skal ændres, kan det imidlertid ikke ske uden, at der tilvejebringes dokumentation for sikkerhed, effekt og eventuelt tilbageholdelsestid, repræsentativt for de ændrede behandlingsregimer.

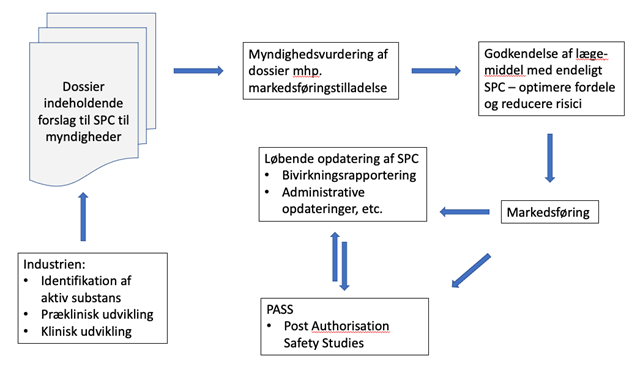
En sådan dokumentation vil meget ofte kræve nye studier eller for ældre velkendte aktiv-substanser eventuelt en bibliografisk gennemgang og sammenfatning af tilgængelig litteratur. Uanset metode er det på alle måder ressourcekrævende og vil tage tid (op til flere år).
Yderligere kompleksitet
Det kan yderligere kompliceres af, at mange ældre aktiv-substanser findes i forskellige godkendte lægemidler, hvor det enkelte lægemiddels godkendelse er baseret på individuelle dossierer indsendt af forskellige lægemiddelfirmaer.
De enkelte firmaer (læs: konkurrenter) har selvsagt ikke adgang til hinandens dossierer. Og uanset hvor stærke interesser den enkelte markedsføringsindehaver måtte have i opdateringer kan SPC’et ikke blot justeres/harmoniseres med henvisning til konkurrentens SPC.
Kun myndighederne har adgang til alle de data, der er indeholdt i de indsendte dossierer. Det er således kun myndighederne, der ved at samle data fra alle dossierer for en given aktiv-substans kan harmonisere SPC’erne for lægemidler, der indeholder den pågældende aktiv-substans. Og det forudsætter, at myndighederne i hele EU erkender problemet, samarbejder og bliver enige om en harmonisering.
Det er komplekst, idet et lægemiddel kan godkendes efter forskellige procedurer:
- Godkendelse kun i Danmark (rent nationalt)
- Godkendelse samtidigt i udvalgte EU-lande (decentral eller gensidig anerkendelsesprocedure)
- Godkendelse i hele EU (central godkendelse).
Dette betyder, at et SPC kan ændres af den enkelte markedsføringsindehaver ved fremskaffelse og indsendelse af dokumentation, som skal kunne godkendes af alle involverede myndigheder.
Tilsammen betyder det, at det at ændre et SPC langt fra er ligetil. Der er dog heller ikke nogen af de involverede parter, der ikke anerkender udfordringerne. Alle arbejder på at finde løsninger, som dels selvfølgelig er lovmedholdelige, dels praktisk mulige for dyrlæger, andre brugere og markedsføringsindehavere.





